Accueil > 02 - Livre Deux : SCIENCES > Atome : lois de la Physique ou rétroaction de la matière/lumière et du (...) > Richard Feynman, Atomes en mouvement - Atoms in Motion
Richard Feynman, Atomes en mouvement - Atoms in Motion
mercredi 24 octobre 2018, par
Le résumé de la leçon au tableau noir de Richard Feynman
Richard Feynman, Atomes en mouvement - Atoms in Motion
Atomes en mouvement
1–1 Introduction
Ce cours de physique de deux ans est présenté du point de vue suivant que vous, le lecteur, allez devenir physicien. Ce n’est pas forcément le cas bien sûr, mais c’est ce que suppose chaque professeur dans chaque matière ! Si vous allez devenir physicien, vous aurez beaucoup à étudier : deux cents ans du domaine de la connaissance qui se développe le plus rapidement. Tellement de connaissances, en fait, que vous pourriez penser que vous ne pouvez pas tout apprendre en quatre ans et que vous ne pouvez vraiment pas ; vous devrez aussi faire des études supérieures !
Chose étonnante, malgré l’énorme travail accompli pendant tout ce temps, il est possible de condenser dans une large mesure l’énorme masse de résultats, c’est-à-dire de trouver des lois qui résument toutes nos connaissances. Même ainsi, les lois sont si difficiles à comprendre qu’il est injuste que vous commenciez à explorer ce formidable sujet sans carte ou aperçu des relations entre les différentes parties du sujet de la science. Après ces remarques préliminaires, les trois premiers chapitres exposeront donc les relations de la physique avec le reste des sciences, les relations des sciences les unes avec les autres domaines de la connaissance et le sens de la science afin de nous aider à développer notre « sentiment » sur le sujet.
Vous pourriez vous demander pourquoi nous ne pouvons pas enseigner la physique en donnant simplement les lois de base à la première page, puis en montrant comment elles fonctionnent dans toutes les circonstances possibles, comme nous le faisons en géométrie euclidienne, où nous énonçons les axiomes et faisons ensuite toutes sortes de déductions. (Donc, vous n’êtes pas satisfait d’apprendre la physique en quatre ans, vous voulez l’apprendre en quatre minutes !)
Nous ne pouvons pas le faire de cette manière pour deux raisons. Premièrement, nous ne connaissons pas encore toutes les lois fondamentales : la frontière de l’ignorance s’élargit. Deuxièmement, l’énoncé correct des lois de la physique implique des idées très peu familières et qui nécessitent des mathématiques avancées pour leur description. Par conséquent, il faut une formation préparatoire considérable, même pour comprendre le sens des mots. Non, il n’est pas possible de le faire de cette façon. Nous ne pouvons le faire que pas à pas.
Chaque partie, ou portion de la nature tout entière, n’est toujours qu’une approximation de la connaissance complète, ou de la vérité dans son ensemble dans la mesure où nous la connaissons. En fait, tout ce que nous savons n’est qu’une approximation, car nous savons que nous ne connaissons pas encore toutes les lois. Par conséquent, les choses doivent être apprises uniquement pour être désapprises à nouveau ou, plus vraisemblablement, pour être corrigées.
Le principe même de la science, sa définition, est presque la suivante : le test de toute connaissance est l’expérience.
L’expérience est le seul juge de la « vérité » scientifique. Mais quelle est la source de la connaissance ? D’où viennent les lois à tester ? L’expérience, elle-même, aide à produire ces lois, dans le sens où elle nous donne des indices. Mais il faut aussi de l’imagination pour créer à partir de ces indications les grandes généralisations : deviner les motifs merveilleux, simples, mais très étranges, puis expérimenter pour vérifier à nouveau si nous avons bien deviné. Ce processus d’imagination est si difficile qu’il existe une division du travail en physique : il existe des physiciens théoriciens qui imaginent, déduisent, et devinent de nouvelles lois, mais n’expérimentent pas ; et puis il y a des physiciens expérimentaux qui expérimentent, imaginent, déduisent et devinent.
Nous avons dit que les lois de la nature sont approximatives : nous trouvons d’abord les « mauvaises » lois, puis les « bonnes ».
Maintenant, comment une expérience peut-elle être "fausse" ? D’abord, d’une manière triviale : si quelque chose ne va pas avec l’appareil que vous n’avez pas remarqué. Mais ces choses sont facilement réparées et vérifiées dans les deux sens.
Donc, sans s’attaquer à de telles choses mineures, comment les résultats d’une expérience peuvent-ils être erronés ? Seulement en étant inexact. Par exemple, la masse d’un objet ne semble jamais changer : une toupie a le même poids qu’une autre.
Une « loi » a donc été inventée : la masse est constante, indépendante de la vitesse. Cette « loi » est maintenant jugée incorrecte. On constate que la masse augmente avec la vitesse, mais des augmentations appréciables exigent des vitesses proches de celle de la lumière. Une vraie loi est la suivante : si un objet se déplace à une vitesse inférieure à cent miles par seconde, la masse est constante à une part près d’un million. Sous une forme approximative, c’est une loi correcte. Donc, dans la pratique, on pourrait penser que la nouvelle loi ne fait aucune différence significative. Eh bien oui et non. Pour les vitesses ordinaires, nous pouvons certainement l’oublier et utiliser la simple loi de la masse constante comme bonne approximation. Mais pour les vitesses élevées, nous avons tort, et plus la vitesse est élevée, plus nous avons tort.
Enfin, et c’est le plus intéressant, philosophiquement, nous avons complètement tort avec la loi approximative. Toute notre image du monde doit être modifiée même si la masse ne change que de peu. C’est une chose très particulière à propos de la philosophie ou des idées derrière les lois. Même un très petit effet nécessite parfois de profonds changements dans nos idées.
Maintenant, que devrions-nous enseigner en premier ? Devrions-nous enseigner la loi correcte mais inconnue avec ses idées conceptuelles étranges et difficiles, par exemple la théorie de la relativité, l’espace-temps à quatre dimensions, etc.? Ou devrions-nous d’abord enseigner la loi simple de « masse constante », qui n’est qu’approximative, mais n’implique pas des idées aussi difficiles ? La première est plus excitante, plus merveilleuse et plus amusante, mais la seconde est plus facile à obtenir au début et constitue un premier pas vers une véritable compréhension de la première idée. Ce point se pose encore et encore dans l’enseignement de la physique. À différents moments, nous devrons résoudre le problème de différentes manières, mais à chaque étape, il vaut la peine d’apprendre ce que l’on sait maintenant, son exactitude, son intégration dans tout le reste et comment cela peut changer si nous en apprenons davantage.
Passons maintenant à l’esquisse ou à la carte générale de notre compréhension de la science d’aujourd’hui (en particulier de la physique, mais aussi des autres sciences de la périphérie), de sorte que, lorsque nous nous concentrerons plus tard sur un point particulier, nous aurons une idée de l’arrière-plan, pourquoi ce point particulier est intéressant et comment il s’intègre dans la grande structure. Alors, quelle est notre image globale du monde ?
1–2 La matière est faite d’atomes
Si, dans un cataclysme, toutes les connaissances scientifiques devaient être détruites et si une seule phrase était transmise aux générations suivantes, quelle affirmation contiendrait le plus d’informations en peu de mots ? Je crois que l’hypothèse atomique (ou le fait atomique, comme vous voulez appeler), est que toutes les choses sont constituées d’atomes - de petites particules qui se déplacent dans un mouvement perpétuel, s’attirant quand elles sont un peu éloignées, mais repoussant après avoir été pressées l’une vers l’autre. Vous verrez dans cette phrase qu’il y a une énorme quantité d’informations sur le monde, si juste un peu d’imagination et de réflexion y sont appliquées.

Fig 1-1 – De l’eau agrandie un milliard de fois
Pour illustrer le pouvoir de l’idée atomique, supposons que nous ayons une goutte d’eau un quart de pouce de côté (0,635 cm).
Si nous l’examinons de très près, nous ne voyons que de l’eau - une eau lisse et continue. Même si nous le grossissons avec le meilleur microscope optique disponible - environ deux mille fois -, la goutte d’eau mesurera environ 20 mètres (40 pieds) de large, à peu près la taille d’une grande pièce, et si nous examinions assez attentivement, nous verrions toujours de l’eau relativement douce. - mais ici et là, de petites choses en forme de football vont et viennent. Très intéressant. Ce sont des paramécies.
Vous pouvez vous arrêter ici et devenir si curieux au sujet de la paramécie avec ses cils tremblants et ses corps tordus que vous n’allez pas plus loin, si ce n’est peut-être pour agrandir encore plus la paramécie et voir à l’intérieur. Ceci, bien sûr, est un sujet de biologie, mais pour le moment, nous passons et examinons encore de plus près le matériau de l’eau lui-même, en le grossissant encore deux mille fois. La goutte d’eau s’étend maintenant sur une quinzaine de kilomètres et si nous l’examinons de très près, nous voyons une sorte de fourmillement, quelque chose qui n’a plus une apparence lisse. Cela ressemble à une foule à un match de football vue de très très loin, à une grande distance.
Afin de voir en quoi consiste ce fourmillement, nous allons l’agrandir encore deux cent cinquante fois et nous verrons quelque chose de similaire à ce que montre la Fig. 1–1. Il s’agit d’une image de l’eau magnifiée un milliard de fois, mais idéalisée de plusieurs manières. En premier lieu, les particules sont dessinées de manière simple avec des arêtes vives, ce qui est imprécis. Deuxièmement, par souci de simplicité, ils sont esquissés de manière presque schématique dans un arrangement bidimensionnel, mais ils se déplacent bien sûr en trois dimensions. Notez qu’il existe deux types de "taches" ou de cercles pour représenter les atomes d’oxygène (noir) et d’hydrogène (blanc), et que chaque oxygène est lié à deux hydrogènes. (Chaque petit groupe d’oxygène avec ses deux hydrogènes est appelé une molécule.)
L’image est idéalisée plus loin en ce que les vraies particules de la nature tremblent et rebondissent continuellement, se retournant et se tordant les unes les autres. Vous devrez imaginer cela comme une image dynamique plutôt que statique. Une autre chose qui ne peut pas être illustrée dans un dessin est le fait que les particules sont « collées ensemble », qu’elles s’attirent, que celle-ci est tirée par celle-ci, etc. L’ensemble du groupe est « collé », pour ainsi dire. Par contre, les particules ne se pressent pas les unes dans les autres. Si vous essayez de rapprocher deux d’entre eux de trop près, elles se repoussent.
Les atomes ont un rayon de 1 ou 2 × 10−8 cm. Maintenant, 10−8 cm s’appelle un angström (c’est juste leur nom), nous disons donc qu’ils ont 1 ou 2 angströms (Å) de rayon. Une autre façon de se rappeler leur taille est la suivante : si une pomme est grossie à la taille de la Terre, les atomes dans la pomme sont approximativement de la taille de la pomme originale.
Maintenant, imaginez cette grande goutte d’eau avec toutes ces particules tremblantes collées ensemble et se liguant les unes contre les autres. L’eau garde son volume ; il ne tombe pas en morceaux, à cause de l’attraction des molécules les unes pour les autres. Si la goutte se trouve sur une pente, où elle peut se déplacer d’un endroit à l’autre, l’eau coulera, mais elle ne disparaît pas simplement - les choses ne se séparent pas - en raison de l’attraction moléculaire. Maintenant, le mouvement saccadé est ce que nous représentons sous forme de chaleur : lorsque nous augmentons la température, nous augmentons le mouvement. Si nous chauffons l’eau, le tremblement augmente et le volume entre les atomes augmente, et si le chauffage continue, il arrive un moment où la traction entre les molécules n’est pas suffisante pour les maintenir ensemble et elles s’échappent et se séparent les unes des autres. . Bien sûr, c’est ainsi que nous fabriquons la vapeur d’eau en augmentant la température ; les particules se séparent à cause du mouvement accru.

Fig 1-2 – La vapeur d’eau
A la figure 1-2, on souhaite représenter une image de la vapeur d’eau. Cette image de la vapeur d’eau est erronée : à la pression atmosphérique, il n’y aurait certainement pas plus de trois molécules d’eau sur cette figure. La plupart des carrés de cette taille n’en contiendraient aucun - mais nous en avons accidentellement deux et demi ou trois dans l’image (juste pour que cela n’apparaisse pas tout à fait vide). Maintenant, dans le cas de la vapeur, nous voyons les molécules caractéristiques plus clairement que dans le cas de l’eau. Pour simplifier, les molécules sont dessinées de manière à ce que les atomes d’hydrogène forment un angle de 120 °. En réalité l’angle est de 105∘3 ’et la distance entre le centre de l’hydrogène et le centre de l’oxygène est de 0,957 Å. Nous connaissons donc très bien cette molécule.
Voyons certaines des propriétés de la vapeur de vapeur ou de tout autre gaz.
Les molécules, étant séparées les unes des autres, vont rebondir contre les murs. Imaginez une pièce avec plusieurs balles de tennis (une centaine) qui rebondissent dans un mouvement perpétuel. Quand ils bombardent le mur, cela le repousse. (Bien sûr, il faudrait repousser le mur.) Cela signifie que le gaz exerce une force nerveuse que nos sens grossiers (ne grossissant pas nous-mêmes un milliard de fois) ne perçoivent que comme une poussée moyenne. Afin de confiner un gaz, nous devons appliquer une pression.
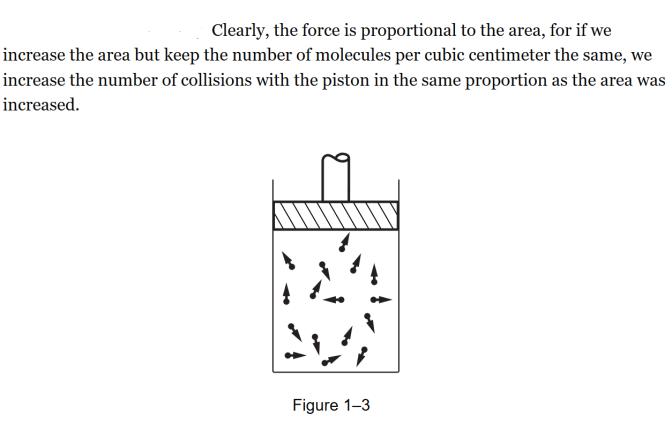
La figure 1-3 montre un récipient standard qui contient du gaz (utilisé dans tous les manuels), un cylindre retenu par un piston. Les formes des molécules d’eau ne font aucune différence. Par souci de simplicité, nous les dessinerons sous forme de balles de tennis ou de petits points. Ces choses sont en perpétuel mouvement dans toutes les directions. Elles sont si nombreuses à frapper constamment le piston supérieur que pour l’empêcher doucement d’être éjecté du réservoir par ces chocs continuels, nous devrons maintenir le piston avec une certaine force, que nous appellerons la pression (en fait, la pression multipliée par la surface est la force). Il est clair que la force est proportionnelle à la surface, car si nous augmentons la surface mais maintenons le même nombre de molécules par centimètre cube, nous augmentons le nombre de collisions avec le piston dans la même proportion que la surface.
Fig 1-3 La pression de gaz dans un cylindre muni d’un piston
Mettons maintenant deux fois plus de molécules dans ce réservoir, de manière à doubler la densité, et donnons-leur la même vitesse, c’est-à-dire la même température. Ensuite, à peu près, le nombre de collisions sera doublé et, comme chacune sera aussi « énergique » qu’auparavant, la pression est proportionnelle à la densité. Si nous considérons la vraie nature des forces entre les atomes, nous nous attendons à une légère diminution de la pression en raison de l’attraction entre les atomes et à une légère augmentation en raison du volume fini qu’ils occupent. Néanmoins, à une excellente approximation, si la densité est suffisamment basse pour qu’il n’y ait pas beaucoup d’atomes, la pression est proportionnelle à la densité.
Nous pouvons également voir autre chose : si nous augmentons la température sans modifier la densité du gaz, c’est-à-dire si nous augmentons la vitesse des atomes, qu’arrivera-t-il à la pression ? Eh bien, les atomes frappent plus fort parce qu’ils se déplacent plus rapidement, et en plus ils frappent plus souvent, donc la pression augmente. Vous voyez à quel point les idées de la théorie atomique sont simples.
Considérons une autre situation. Supposons que le piston se déplace vers l’intérieur, de sorte que les atomes soient lentement comprimés dans un espace plus petit. Que se passe-t-il lorsqu’un atome frappe le piston en mouvement ? Évidemment, il prend de la vitesse après la collision. Vous pouvez l’essayer en faisant rebondir une balle de ping-pong à partir d’une pale qui avance, par exemple, et vous constaterez qu’elle se dégage avec une vitesse supérieure à celle avec laquelle elle a heurté. (Exemple spécial : si un atome reste immobile et que le piston le frappe, il se déplacera certainement.) Ainsi, les atomes sont « plus chauds » quand ils quittent le piston qu’ils ne l’étaient avant de le frapper. Par conséquent, tous les atomes présents dans le vaisseau auront pris de la vitesse.
Cela signifie que lorsque nous comprimons un gaz lentement, sa température augmente. Ainsi, sous une compression lente, la température d’un gaz augmente et, sous une expansion lente, sa température diminue.
Fig 1-4 – La glace
Nous revenons maintenant à notre goutte d’eau et regardons dans une autre direction. Supposons que nous diminuions la température de notre goutte d’eau. Supposons que le branlement des molécules des atomes de l’eau diminue progressivement. Nous savons qu’il existe des forces d’attraction entre les atomes, de sorte qu’au bout d’un moment, ils ne pourront plus si bien se trémousser. Les figures 1–4 indiquent ce qui se passera aux très basses températures : les molécules se verrouillent dans un nouveau motif, la glace.
Ce diagramme schématique de la glace est faux car il est en deux dimensions, mais il est correct qualitativement. Le point intéressant est que le matériau a une place définie pour chaque atome, et vous pouvez facilement comprendre que si d’une manière ou d’une autre nous tenions tous les atomes à une extrémité de la goutte dans un certain arrangement, chaque atome à un certain endroit, puis, en raison de la structure des interconnexions, qui est rigide, l’autre extrémité se situant à des kilomètres (à notre échelle grossie) aura un emplacement précis. Donc, si nous tenons une aiguille de glace à une extrémité, l’autre extrémité résiste à notre éloignement, contrairement à l’eau, dans laquelle la structure est dégradée à cause du branlement accru, de sorte que les atomes se déplacent de différentes manières.
La différence entre les solides et les liquides réside donc dans le fait que dans un solide, les atomes sont disposés en une sorte de réseau appelé réseau cristallin et qu’ils n’ont pas de position aléatoire à grande distance ; la position des atomes d’un côté du cristal est déterminée par celle d’autres atomes distants de plusieurs millions d’atomes de l’autre côté du cristal. La figure 1-4 est un arrangement inventé pour la glace. Bien qu’il contienne bon nombre des caractéristiques correctes de la glace, ce n’est pas le vrai arrangement. Une des caractéristiques correctes est qu’il existe une partie de la symétrie hexagonale.
Vous pouvez voir que si nous tournons l’image autour d’un axe de 60 °, l’image revient à elle-même. Il y a donc une symétrie dans la glace qui explique l’apparition sur six faces de flocons de neige. Les figures 1–4 montrent également pourquoi la glace rétrécit lorsqu’elle fond. Le motif cristallin de glace présenté ici comporte de nombreux « trous », tout comme la véritable structure de la glace. Lorsque l’organisation se décompose, ces trous peuvent être occupés par des molécules. La plupart des substances simples, à l’exception de l’eau et du type de métal, se dilatent lors de la fusion, car les atomes sont étroitement encombrés dans le cristal solide et nécessitent par conséquent plus d’espace pour bouger, mais une structure ouverte s’effondre, comme dans le cas de l’eau.
Maintenant, bien que la glace ait une forme cristalline « rigide », sa température peut changer - la glace a de la chaleur. Si nous le souhaitons, nous pouvons modifier la quantité de chaleur. Quelle est la chaleur dans le cas de la glace ? Les atomes ne sont pas immobiles. Ils bougent et vibrent. Ainsi, même s’il existe un ordre défini pour le cristal - une structure définie - tous les atomes vibrent « sur place ». Lorsque nous augmentons la température, ils vibrent avec une amplitude de plus en plus grande, jusqu’à ce qu’ils se secouent hors de propos. Nous appelons cela la fonte. À mesure que nous diminuons la température, les vibrations diminuent et diminuent jusqu’à obtenir, au zéro absolu, une quantité minimale de vibrations que les atomes puissent avoir, mais pas zéro. Cette quantité minimale de mouvement que peuvent avoir les atomes ne suffit pas à faire fondre une substance, à une exception près : l’hélium. L’hélium réduit simplement les mouvements atomiques autant qu’il peut, mais même au zéro absolu, il y a encore assez de mouvement pour l’empêcher de geler. L’hélium, même au zéro absolu, ne gèle pas, à moins que la pression ne soit suffisamment forte pour que les atomes s’écroulent ensemble. Si nous augmentons la pression, nous pouvons le faire se solidifier.
1-3 Processus atomiques
Fig 1-5 – L’eau s’évaporant dans l’air - Molécules d’Oxygène, Hydrogène et Azote
Voilà pour la description des solides, des liquides et des gaz du point de vue atomique. Cependant, l’hypothèse atomique décrit également les processus et nous allons donc maintenant examiner un certain nombre de processus d’un point de vue atomique. Le premier processus que nous allons examiner est associé à la surface de l’eau.
Que se passe-t-il à la surface de l’eau ? Nous allons maintenant rendre le tableau plus compliqué - et plus réaliste - en imaginant que la surface est dans l’air. La figure 1–5 montre la surface de l’eau dans l’air. Nous voyons les molécules d’eau comme auparavant, formant une masse d’eau liquide, mais nous voyons maintenant aussi la surface de l’eau. Au-dessus de la surface, nous trouvons un certain nombre de choses : Tout d’abord, il existe des molécules d’eau, comme dans la vapeur. C’est de la vapeur d’eau, qui se trouve toujours au dessus de l’eau liquide. (Il y a un équilibre entre la vapeur d’eau et l’eau qui sera décrit plus tard.) De plus, nous trouvons d’autres molécules - ici, deux atomes d’oxygène collés ensemble, formant une molécule d’oxygène, deux atomes d’azote collés également pour former une molécule d’azote.
L’air est presque entièrement constitué d’azote, d’oxygène, de vapeur d’eau et de quantités moindres de dioxyde de carbone, d’argon et d’autres substances. Donc, au-dessus de la surface de l’eau se trouve l’air, un gaz contenant de la vapeur d’eau. Maintenant que se passe-t-il dans cette image ? Les molécules dans l’eau bougent constamment. De temps en temps, une personne à la surface se fait frapper un peu plus fort que d’habitude et est renversée. Il est difficile de voir cela se produire sur l’image car il s’agit d’une image fixe.
Mais nous pouvons imaginer qu’une molécule près de la surface vient d’être touchée et s’envole, ou peut-être une autre l’a-t-elle été et s’envole-t-elle. Ainsi, molécule par molécule, l’eau disparaît, elle s’évapore. Mais si nous fermons le vaisseau au-dessus, nous trouverons au bout d’un moment un grand nombre de molécules d’eau parmi les molécules d’air. De temps en temps, une de ces molécules de vapeur vole dans l’eau et se bloque à nouveau. Nous voyons donc que ce qui ressemble à une chose morte et sans intérêt - un verre d’eau recouvert d’une couverture, qui y est depuis une vingtaine d’années - contient en réalité un phénomène dynamique et intéressant qui se poursuit tout le temps. À nos yeux, à l’œil nu, rien ne change, mais si nous pouvions le voir grossir des milliards de fois, nous verrions que, de son point de vue, cela change tout le temps : des molécules quittent la surface, des molécules reviennent.
Pourquoi ne voyons-nous aucun changement ? Car autant de molécules partent que reviennent ! À long terme, « rien ne se passe ». Si nous retirons ensuite le sommet du récipient et soufflons l’air humide en le remplaçant par de l’air sec, le nombre de molécules qui restent est identique à celui d’avant, car cela dépend de l’agitation de l’eau, mais le nombre de retours est considérablement réduit car il y a beaucoup moins de molécules d’eau au-dessus de l’eau. Par conséquent, il y a plus de sorties que d’entrées et l’eau s’évapore. Par conséquent, si vous souhaitez évaporer l’eau, allumez le ventilateur !
Voici quelque chose d’autre : Quelles molécules partent ? Quand une molécule s’en va, elle est due à une accumulation accidentelle supplémentaire d’un peu plus que l’énergie ordinaire dont elle a besoin pour se détacher des attractions de ses voisins. Par conséquent, puisque ceux qui partent ont plus d’énergie que la moyenne, ceux qui restent ont moins de mouvement moyen qu’avant. Ainsi, le liquide refroidit progressivement s’il s’évapore. Bien sûr, quand une molécule de vapeur vient de l’air dans l’eau, il y a une soudaine grande attraction lorsque la molécule s’approche de la surface. Cela accélère l’entrée de la molécule et entraîne la génération de chaleur. Alors quand ils partent, ils enlèvent la chaleur ; quand ils reviennent, ils génèrent de la chaleur. Bien sûr, lorsqu’il n’y a pas d’évaporation nette, le résultat n’est rien : l’eau ne change pas de température. Si nous soufflons sur l’eau de manière à maintenir une prépondérance constante dans le nombre de liquides qui s’évaporent, l’eau est refroidie. Par conséquent, soufflez sur la soupe pour la refroidir !
Bien entendu, vous devez comprendre que les processus que nous venons de décrire sont plus compliqués que ceux que nous avons indiqués. Non seulement l’eau pénètre dans l’air, mais aussi, de temps en temps, une des molécules d’oxygène ou d’azote entre et se « perd » dans la masse de molécules d’eau, puis s’infiltre dans l’eau. Ainsi, l’air se dissout dans l’eau ; les molécules d’oxygène et d’azote se frayent un chemin dans l’eau et celle-ci contient de l’air. Si nous retirons soudainement l’air du vaisseau, les molécules d’air partiront plus rapidement qu’elles ne le feraient entrer, ce qui ferait des bulles. C’est très mauvais pour les plongeurs, comme vous le savez peut-être.

Fig 1-6 – Sel dissous dans l’eau
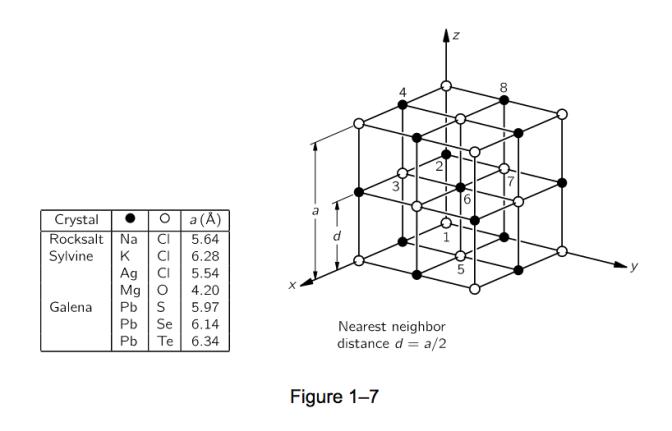
Fig 1-7 – Plus proche molécule voisine
Nous passons maintenant à un autre processus. Les figures 1–6 montrent, d’un point de vue atomique, un solide en dissolution dans l’eau. Si on met un cristal de sel dans l’eau, que va-t-il se passer ?
Le sel est un solide, un cristal, un agencement organisé d ’« atomes de sel ». La figure 1–7 illustre la structure tridimensionnelle du sel commun, le chlorure de sodium. Strictement parlant, le cristal n’est pas fait d’atomes, mais de ce que nous appelons des ions. Un ion est un atome qui a quelques électrons supplémentaires ou qui en a perdu quelques-uns. Dans un cristal de sel, on trouve des ions chlore (atomes de chlore avec un électron supplémentaire) et des ions sodium (atomes de sodium avec un électron manquant). Les ions collent tous ensemble par attraction électrique dans le sel solide, mais lorsque nous les mettons à l’eau, nous constatons que certains ions se détachent à cause des attractions de l’oxygène négatif et de l’hydrogène positif pour les ions. Sur les figures 1 à 6, nous voyons un ion chlore se détacher et d’autres atomes flottant dans l’eau sous forme d’ions. Cette photo a été faite avec soin. Notez, par exemple, que les extrémités hydrogène des molécules d’eau sont plus susceptibles d’être proches de l’ion chlore, tandis que près de l’ion sodium, nous avons plus de chance de trouver l’extrémité oxygène, car le sodium est positif et l’extrémité oxygène de l’eau est négatif, et ils attirent électriquement.
Pouvons-nous savoir à partir de cette image si le sel se dissout dans l’eau ou se cristallise dans l’eau ? Bien sûr, nous ne pouvons pas le dire, car pendant que certains atomes quittent le cristal, d’autres atomes le rejoignent. Le processus est dynamique, tout comme dans le cas de l’évaporation, et dépend de la présence de plus ou moins de sel dans l’eau que la quantité nécessaire à l’équilibre. Par équilibre, nous entendons la situation dans laquelle la vitesse à laquelle les atomes quittent correspond à la vitesse à laquelle ils reviennent. S’il n’y a presque pas de sel dans l’eau, il reste plus d’atomes que de retours et le sel se dissout. Si, en revanche, il y a trop d ’« atomes de sel », plus de retour que de congé et le sel cristallise.
En passant, nous mentionnons que le concept de molécule de substance n’est qu’approximatif et n’existe que pour une certaine classe de substances. Dans le cas de l’eau, il est clair que les trois atomes sont réellement collés. Ce n’est pas aussi clair dans le cas du chlorure de sodium dans le solide. Il y a juste un arrangement d’ions de sodium et de chlore dans un motif cubique. Il n’y a pas de moyen naturel de les regrouper en « molécules de sel ».
Pour en revenir à notre discussion sur la solution et la précipitation, si nous augmentons la température de la solution de sel, la vitesse à laquelle les atomes sont éliminés est augmentée, de même que la vitesse à laquelle les atomes sont ramenés. En général, il est très difficile de prédire la direction à prendre, si plus ou moins de solide se dissoudra. La plupart des substances se dissolvent plus, mais certaines se dissolvent moins à mesure que la température augmente.
1-4 Réactions chimiques
Dans tous les processus décrits jusqu’à présent, les atomes et les ions n’ont pas changé de partenaire, mais il existe bien sûr des circonstances dans lesquelles les atomes changent de combinaisons, formant de nouvelles molécules. Ceci est illustré aux Fig. 1–8. Un processus dans lequel intervient le réarrangement des partenaires atomiques est ce que nous appelons une réaction chimique. Les autres processus décrits jusqu’ici sont appelés processus physiques, mais il n’y a pas de distinction nette entre les deux. (La nature ne se soucie pas de ce que nous appelons cela, elle continue juste à le faire.) Ce chiffre est censé représenter le carbone brûlant dans l’oxygène. Dans le cas de l’oxygène, deux atomes d’oxygène sont très fortement liés. (Pourquoi ne pas en tenir trois, voire quatre ? C’est l’une des caractéristiques très particulières de tels processus atomiques. Les atomes sont très particuliers : ils aiment certains partenaires, certaines directions particulières, et cetera. C’est le rôle de la physique d’analyser pourquoi chacun veut ce qu’il veut. En tout cas, deux atomes d’oxygène forment une molécule saturée et heureuse.)
Fig 1-8 Carbone brûlant dans l’Oxygène
Les atomes de carbone sont supposés être dans un cristal solide (qui peut être du graphite ou du diamant1). Maintenant, par exemple, l’une des molécules d’oxygène peut atteindre le carbone et chaque atome peut capter un atome de carbone et s’envoler dans une nouvelle combinaison - "oxygène carbone" - qui est une molécule du gaz appelée carbone monoxyde. On lui donne le nom chimique CO. C’est très simple : les lettres « CO » sont pratiquement une image de cette molécule. Mais le carbone attire beaucoup plus l’oxygène que l’oxygène attire l’oxygène ou le carbone attire le carbone. Par conséquent, dans ce processus, l’oxygène peut arriver avec seulement un peu d’énergie, mais l’oxygène et le carbone vont s’unir avec une vengeance et une commotion énormes, et tout ce qui se trouve à proximité va capter l’énergie. Une grande quantité d’énergie de mouvement, une énergie cinétique, est ainsi générée. Ceci est bien sûr en train de brûler ; nous obtenons de la chaleur de la combinaison de l’oxygène et du carbone. La chaleur prend généralement la forme du mouvement moléculaire du gaz chaud, mais dans certaines circonstances, elle peut être si énorme qu’elle génère de la lumière. C’est comme ça qu’on obtient des flammes.
De plus, le monoxyde de carbone n’est pas tout à fait satisfait. Il est possible qu’il attache un autre oxygène, de sorte que nous puissions avoir une réaction beaucoup plus compliquée dans laquelle l’oxygène se combine au carbone, alors qu’il se produit en même temps une collision avec une molécule de monoxyde de carbone. Un atome d’oxygène pourrait se fixer au CO et former une molécule composée d’un carbone et de deux oxygènes, appelée CO2 et appelée dioxyde de carbone. Si nous brûlons le carbone avec très peu d’oxygène lors d’une réaction très rapide (par exemple, dans un moteur d’automobile, où l’explosion est si rapide qu’il n’a pas le temps de produire du dioxyde de carbone), une quantité considérable de monoxyde de carbone se forme. Dans beaucoup de ces réarrangements, une très grande quantité d’énergie est libérée, formant des explosions, des flammes, etc., en fonction des réactions. Les chimistes ont étudié ces arrangements d’atomes et ont découvert que chaque substance est un type d’arrangement d’atomes.
Pour illustrer cette idée, considérons un autre exemple. Si nous allons dans un champ de petites violettes, nous savons ce qu’est « cette odeur ». C’est une sorte de molécule, ou arrangement d’atomes, qui a fait son chemin dans notre nez. Tout d’abord, comment cela at-il fonctionné ? C’est plutôt facile. Si l’odeur est une sorte de molécule dans l’air, qui s’agite et qui est renversée, elle aurait peut-être pénétré accidentellement dans le nez. Certes, il n’a aucun désir particulier d’entrer dans notre nez. C’est simplement une partie impuissante d’une foule de molécules qui se bousculent et, dans ses vagabondages sans but, ce morceau de matière en particulier se trouve dans le nez.
Fig 1-9 L’odeur de violettes
Maintenant, les chimistes peuvent prendre des molécules spéciales comme l’odeur de violette, les analyser et nous dire la disposition exacte des atomes dans l’espace. Nous savons que la molécule de dioxyde de carbone est droite et symétrique : O — C — O. (Cela peut être facilement déterminé, aussi, par des méthodes physiques.) Cependant, même pour les arrangements d’atomes beaucoup plus compliqués qu’il y a en chimie, on peut, par un long et remarquable processus de travail de détective, trouver les arrangements des atomes . Les figures 1 à 9 sont une image de l’air au voisinage d’une violette ; de nouveau, nous trouvons de l’azote et de l’oxygène dans l’air et de la vapeur d’eau. (Pourquoi y a-t-il de la vapeur d’eau ? Parce que la violette est humide. Toutes les plantes transpirent.) Cependant, nous voyons aussi un "monstre" composé d’atomes de carbone, d’atomes d’hydrogène et d’oxygène, qui ont choisi un certain modèle particulier arrangé. C’est un arrangement beaucoup plus compliqué que celui du dioxyde de carbone ; en fait, c’est un arrangement extrêmement compliqué. Malheureusement, nous ne pouvons pas visualiser chimiquement tout ce que nous savons réellement à ce sujet, car la disposition précise de tous les atomes est en réalité connue en trois dimensions, alors que notre image n’est que de deux dimensions. Les six atomes de carbone qui forment un anneau ne forment pas un anneau plat, mais une sorte d’anneau « plissé ». Tous les angles et les distances sont connus. Donc, une formule chimique est simplement une image d’une telle molécule. Lorsque le chimiste écrit une telle chose au tableau, il tente de « dessiner », en gros, en deux dimensions. Par exemple, nous voyons un « anneau » de six atomes de carbone et une « chaîne » d’atomes suspendus au bout, avec un oxygène en partant du bout, trois atomes d’hydrogène liés à ce carbone, deux atomes de carbone et trois atomes d’hydrogène accrochés ici, etc. .
Fig 1-10 - La substance représentée est du fer α.
Comment le chimiste trouve-t-il quel est l’arrangement ? Il mélange des bouteilles pleines de choses, et si ça devient rouge, ça lui dit que ça consiste en un hydrogène et deux carbones attachés ici ; si elle devient bleue, par contre, ce n’est pas du tout comme ça. Il s’agit de l’un des travaux de détective les plus fantastiques jamais réalisés : la chimie organique. Pour découvrir la disposition des atomes dans ces réseaux extrêmement complexes, le chimiste examine ce qui se passe lorsqu’il mélange deux substances différentes. Le physicien ne pouvait jamais croire que le chimiste savait de quoi il parlait lorsqu’il décrivait la disposition des atomes. Pendant une vingtaine d’années environ, il a été possible, dans certains cas, d’examiner de telles molécules (pas aussi compliquées que celle-ci, mais certaines en contiennent) par une méthode physique, et il a été possible de localiser chaque atome, non pas en regardant les couleurs, mais en mesurant où elles se trouvent. Et voilà, les chimistes ont presque toujours raison.
En fait, il se trouve que dans l’odeur des violettes se trouvent trois molécules légèrement différentes, qui ne diffèrent que par la disposition des atomes d’hydrogène.
Un des problèmes de la chimie consiste à nommer une substance afin de savoir de quoi il s’agit. Trouvez un nom pour cette forme ! Non seulement le nom doit indiquer la forme, mais il doit également indiquer qu’il existe un atome d’oxygène, un atome d’hydrogène, exactement quoi et où se trouve chaque atome. Nous pouvons donc comprendre que les noms chimiques doivent être complexes pour être complets. Vous voyez que le nom de cette chose dans la forme plus complète qui vous indiquera la structure de celle-ci est 4- (2, 2, 3, 6 tétraméthyl-5-cyclohexényl) -3-butène-2-one, et cela vous que c’est l’arrangement. Nous pouvons comprendre les difficultés rencontrées par les chimistes et comprendre également la raison de la longueur de ces noms. Ce n’est pas qu’ils souhaitent être obscurs, mais ils ont un problème extrêmement difficile à essayer de décrire les molécules en mots !
Comment savons-nous qu’il y a des atomes ? Par l’une des astuces mentionnées plus haut : nous émettons l’hypothèse de la présence d’atomes, et les résultats se succèdent l’une après l’autre comme nous le prévoyons, comme il se doit si les choses sont faites d’atomes. Il existe également des preuves un peu plus directes, dont le bon exemple est le suivant : Les atomes sont si petits que vous ne pouvez pas les voir avec un microscope optique - en fait, même avec un microscope électronique. (Avec un microscope optique, vous ne pouvez voir que des choses beaucoup plus grandes.) Maintenant, si les atomes sont toujours en mouvement, disons dans de l’eau, et nous mettons une grosse boule de quelque chose dans l’eau, une boule beaucoup plus grande que les atomes, le la balle va bouger, comme dans un jeu de push ball où beaucoup de gens poussent une grosse balle. Les gens poussent dans différentes directions et la balle se déplace de manière irrégulière sur le terrain. Ainsi, de la même manière, la "grosse boule" bougera à cause des inégalités des collisions d’un côté à l’autre, d’un moment à l’autre. Par conséquent, si nous examinons les très petites particules (colloïdes) présentes dans l’eau à travers un excellent microscope, nous assistons à un remue-ménage perpétuel des particules, résultat du bombardement des atomes. C’est ce qu’on appelle le mouvement brownien.
Nous pouvons voir d’autres preuves de la présence d’atomes dans la structure des cristaux. Dans de nombreux cas, les structures déduites par l’analyse aux rayons X concordent dans leurs « formes » spatiales avec les formes réellement présentées par les cristaux tels qu’ils se présentent dans la nature. Les angles entre les différentes "faces" d’un cristal s’accordent, en quelques secondes d’arc, avec des angles déduits en supposant qu’un cristal est composé de nombreuses "couches" d’atomes.
Tout est fait d’atomes. C’est l’hypothèse clé. L’hypothèse la plus importante dans toute la biologie, par exemple, est que tout ce que font les animaux, les atomes font. En d’autres termes, il n’ya rien que les êtres vivants fassent qui ne puisse être compris du point de vue qu’ils sont constitués d’atomes agissant selon les lois de la physique. Cela n’était pas connu depuis le début : il a fallu quelques expérimentations et théories pour suggérer cette hypothèse, mais maintenant elle est acceptée et c’est la théorie la plus utile pour produire de nouvelles idées dans le domaine de la biologie.
Si un morceau d’acier ou un morceau de sel, constitué d’atomes l’un à côté de l’autre, peut avoir de telles propriétés intéressantes ; si l’eau - qui n’est rien d’autre que ces petites boules, un kilomètre et un kilomètre de la même chose sur la terre - peut former des vagues et de la mousse, et faire des bruits pressants et des motifs étranges en parcourant du ciment ; si tout cela, toute la vie d’un courant d’eau, ne peut être qu’un tas d’atomes, combien plus est possible ? Si, au lieu de disposer les atomes selon un motif précis, répétés encore et encore, encore et encore, ou même de former de petits blocs complexes comme l’odeur de violette, nous réalisons un arrangement toujours différent d’un endroit à l’autre, avec différents types de des atomes disposés à bien des égards, changeant continuellement, ne répétant pas, à quel point est-il encore plus merveilleux que cette chose puisse se comporter ? Est-il possible que cette "chose" qui va et vient devant vous, qui vous parle, soit un grand globe de ces atomes dans un arrangement très complexe, de telle sorte que la complexité de celui-ci étonne l’imagination quant à ce qu’il peut faire ? Lorsque nous disons que nous sommes un tas d’atomes, nous ne voulons pas dire que nous sommes simplement un tas d’atomes, car un tas d’atomes qui ne se répète pas d’un à l’autre pourrait bien avoir les possibilités que vous voyez devant vous dans le miroir.
Note
1- On peut brûler un diamant dans l’air.
Read in English :
Lire aussi :
Quelles sont les idées défendues par le physicien Richard Feynman ?
Que dites-vous de la relation matière lumière, monsieur Feynman ?
Chaleur et molécules en mouvement